Benedetta Fiordi, PhD dans le laboratoire de la Prof. Camilla Jandus, (UNIGE) – (Leucémie aiguë myéloïde)
Le rôle du facteur neurotrophique dérivé du cerveau dans le contrôle neuro-immunitaire de la leucémie aigüe myéloïde
Cette « bourse PhD » a été attribuée à Benedetta Fiordi en mars 2023 pour une durée de 3 ans. Benedetta Fiordi effectue ses travaux dans le laboratoire de la Prof. Camilla Jandus, Université de Genève.
Le système immunitaire et le système nerveux périphérique sillonnent l’ensemble du corps et coopèrent pour assurer que les organes vitaux maintiennent l’homéostasie et la santé globale de l’individu. Cependant, les mécanismes conduisant à la modification ou à l’abolition de cette coopération dans le contexte d’un cancer, en particulier celui de la leucémie, restent mal compris. Des investigations plus approfondies, visant à identifier des déterminants pouvant être ciblés pour rétablir les interactions normales, sont donc nécessaires. Les leucémies sont un groupe de cancers du sang, ayant pour origine la moëlle osseuse (MO), un tissu fortement innervé.
Dans ce projet, je concentrerai mes efforts sur la leucémie aigüe myéloïde (LAM), une maladie qu’il est urgent de mieux comprendre, car le taux de survie est inférieur à 20% en raison de résistances aux médicaments et de rechutes. La cause principale d’échec du traitement de la LAM sont les cellules souches leucémiques (CSL) résistantes à la chimiothérapie. Celles-ci subsistent et donnent naissance à d’autres clones leucémiques capables de proliférer et de s’établir. Les CSL résident dans la MO. Elles sont entretenues par les cellules et facteurs solubles, dont des facteurs d’origine neurale, qui constituent le micro-environnement de la MO, également appelé niche hématopoïétique. Des résultats publiés précédemment par mon laboratoire hôte indiquent qu’au moment de l’apparition de la LAM, des cellules lymphoïdes innées (CLI) sont présentes mais fonctionnellement dérégulées dans la MO des patients, et que leur fonction ne se rétablit que partiellement suite à une chimiothérapie.
Les cellules lymphoïdes innées (CLI) sont une famille de cellules immunitaires nouvellement décrite, impliquée dans l’homéostasie tissulaire, ainsi que dans les maladies inflammatoires et le cancer. Cependant, la manière dont les CLI interagissent avec les cellules malignes, y compris les CSL, reste à être élucidée, et on ne sait pas encore si cette interaction est modulée par des facteurs neurotrophiques. Parmi les facteurs dérivés du système nerveux, je concentrerai mes recherches sur le rôle du facteur neurotrophique dérivé du cerveau (BDNF, brain-derived neurotrophic factor). Le BDNF est associé à une issue favorable dans la leucémie lymphoïde chronique (LLC). Mes expériences préliminaires ont en outre révélé qu’il se trouve considérablement réduit dans le sang périphérique (SP) et la MO de patients atteints de LAM. L’objectif de ce projet sera de déterminer si sa perte affecte les fonction anti-tumorales des CLI, et s’il favorise la survie des CSL et/ou module l’interaction de ces deux types de cellules.
Je prévois donc de disséquer le rôle du BDNF dans le contrôle neuro-immunitaire de la LAM, 1) en identifiant les acteurs cellulaires et moléculaires impliqués dans la voie de signalisation BDNF-récepteur tropomyosine kinase B (TrkB) (1er objectif) ; 2) en disséquant les échanges entre cellules immunitaires et tumeur/stroma impliquant le BDNF (2e objectif) ; et 3) en évaluant l’impact du BDNF sur l’élimination de la leucémie in vivo (3e objectif). Dans l’ensemble, j’espère pouvoir mettre en évidence une nouvelle strate de l’immunité tumorale, à savoir le circuit neuro-immunitaire impliqué dans la leucémie, représentant potentiellement un facteur clé dans la progression de la maladie et la réponse au traitement.
Représentation schématique du projet
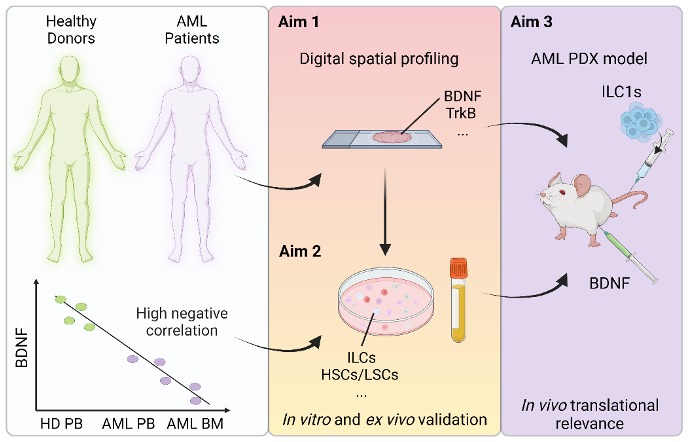
Healthy donors = Donneurs sains | AML patients = Patients atteints de LAM | High negative correlation = Corrélation négative étroite | Aim 1 = 1er objectif | Digital spatial profiling = Profilage spatial numérique | Aim 2 = 2e objectif | In vitro and ex vivo validation = Validation in vitro et ex vivo | Aim 3 = 3e objectif | AML PDX model Modèle = PDX de la LAM | In vivo translational relevance | Pertinence translationnelle in vivo

