Le rôle des cellules tueuses naturelles dans le lymphome cutané à cellules T : mécanismes pathophysiologiques et implications cliniques
Cette « bourse MD-PhD » a été attribuée à Christoph Iselin en mai 2023 pour une durée de 3 ans. Christoph Iselin effectue ses travaux dans le laboratoire de la Prof. Emmanuella Guenova, Université de Lausanne.
Les lymphomes cutanés à cellules T (CTCL) sont un groupe de lymphomes non hodgkiniens rares mais potentiellement létaux, tirant leur origine de lymphocytes T CD4+ malins. On estime que le système immunitaire du patient représente un facteur important dans la progression du CTCL, et que les thérapies immunomodulatrices contribuent de manière fiable à l’issue de la maladie. Afin d’être en mesure d’améliorer les options thérapeutiques, il est donc impératif de comprendre l’influence du CTCL sur le système immunitaire et ses cellules.
Les effets immunomodulateurs du CTCL provoquent l’épuisement des cellules immunitaires. Ce phénomène explique les résultats jusqu’à présent décevants des thérapies dépendant des lymphocytes T et des cellules dendritiques, en comparaison des résultats obtenus avec d’autres types de cancer. Cependant, des découvertes récentes indiquent que les cellules tueuses naturelles (cellules NK) sont impliquées dans la réponse du CTCL au traitement immunomodulateur.
Compte tenu de la nature immunomodulatrice du CTCL, de son microenvironnement fortement immunosuppresseur et de l’activité anti-tumorale réduite des cellules NK chez les patients atteints de CTCL, j’émets l’hypothèse suivante : la suppression de la fonction des cellules NK, induite par le micro-environnement tumoral, représente un facteur décisif dans la progression du CTCL. Ainsi, le sauvetage de l’activité des cellules NK peut servir de stratégie efficace de traitement du CTCL et des maladies cancéreuses en général.
L’objectif global de ce projet est d’inverser l’activité affaiblie des cellules NK induite par le CTCL, en ciblant les facteurs responsables de la régulation négative de la fonction de ces cellules. La première étape consistera à déterminer, moyennant le séquençage de cellules uniques, le phénotype des cellules NK présentes dans le micro-environnement tissulaire du CTCL. Je scruterai ce vaste ensemble de données à la recherche de facteurs et de voies de signalisation altérant spécifiquement les cellules NK du CTCL. Les mêmes cellules, mais issues de peau saine, de maladies cutanées inflammatoires et de tumeurs solides de la peau, serviront de comparaison.
Toutes les molécules candidates seront ensuite validées individuellement dans des cellules NK de patients CTCL, ainsi que dans des cellules NK témoins issues d’individus atteints des maladies énumérées ci-dessus. La validation se fera moyennant la PCR à transcriptase inverse (RT-PCR), le tri cellulaire activé par fluorescence (FACS) et l’immunoblotting de protéines. Le nombre et l’état d’activation des cellules NK seront comparés aux données cliniques existantes spécifiques à chaque patient, dans le but d’évaluer l’impact du stade et de la progression de la maladie. Je testerai ensuite la réversibilité de l’effet suppresseur des molécules candidates les plus prometteuses sur l’activité des cellules NK in vitro. Puis je développerai un plan de thérapie combinée pour le traitement du CTCL dans un modèle syngénique de lymphome à cellules T. Cette stratégie me permettra de déterminer in vivo si les molécules cibles identifiées au cours des deux premières étapes peuvent servir à restituer le potentiel anti-tumoral des cellules NK et à améliorer l’issue de la maladie.
Si ce projet aboutit, il fera progresser notre compréhension du rôle des cellules NK dans la pathologie et le traitement du CTCL, ainsi que des maladies cutanées inflammatoires et des tumeurs solides de la peau. Les facteurs et les voies de signalisation identifiés par analyse numérique, validés expérimentalement in vitro comme étant réversibles et dont l’efficacité a été prouvée in vivo pourront former la base d’études ultérieures visant à déterminer leur applicabilité clinique.
Analyse de TREM2 dans l’inhibition des cellules lymphoïdes dans la LAM
Cette « bourse PhD » a été attribuée à Benedetta Fiordi en mars 2023 pour une durée de 3 ans. Benedetta Fiordi effectue ses travaux dans le laboratoire de la Prof. Camilla Jandus, Université de Genève.
Le système immunitaire et le système nerveux périphérique sillonnent l’ensemble du corps et coopèrent pour assurer que les organes vitaux maintiennent l’homéostasie et la santé globale de l’individu. Cependant, les mécanismes conduisant à la modification ou à l’abolition de cette coopération dans le contexte d’un cancer, en particulier celui de la leucémie, restent mal compris. Des investigations plus approfondies, visant à identifier des déterminants pouvant être ciblés pour rétablir les interactions normales, sont donc nécessaires. Les leucémies sont un groupe de cancers du sang, ayant pour origine la moëlle osseuse (MO), un tissu fortement innervé.
Dans ce projet, je concentrerai mes efforts sur la leucémie aigüe myéloïde (LAM), une maladie qu’il est urgent de mieux comprendre, car le taux de survie est inférieur à 20% en raison de résistances aux médicaments et de rechutes. La cause principale d’échec du traitement de la LAM sont les cellules souches leucémiques (CSL) résistantes à la chimiothérapie. Celles-ci subsistent et donnent naissance à d’autres clones leucémiques capables de proliférer et de s’établir. Les CSL résident dans la MO. Elles sont entretenues par les cellules et facteurs solubles, dont des facteurs d’origine neurale, qui constituent le micro-environnement de la MO, également appelé niche hématopoïétique. Des résultats publiés précédemment par mon laboratoire hôte indiquent qu’au moment de l’apparition de la LAM, des cellules lymphoïdes innées (ICL) sont présentes mais fonctionnellement dérégulées dans la MO des patients, et que leur fonction ne se rétablit que partiellement suite à une chimiothérapie.
La famille des cellules lymphoïdes innées comprend deux groupes principaux : les ICL auxiliaires (hILC) et les cellules tueuses naturelles (NK). Les hILC peuvent être divisées en trois sous-types (ILC1, ILC2 et ILCP), tandis que les NK comprennent des cellules NK1/NK3 et NK2. Il est intéressant de noter que les ILC1 et les NK partagent de nombreuses caractéristiques : elles peuvent être activées par des cytokines similaires et sécrètent toutes deux de l’IFN-gamma et du TNF-alpha. L’hypothèse de mon projet de doctorat est que deux facteurs, le facteur neurotrophique dérivé du cerveau (BDNF) et le sTREM2, pourraient jouer un rôle critique dans l’altération des fonctions anti-leucémiques des ILC dans la LAM. J’ai obtenu des résultats prometteurs principalement sur sTREM2,et je me concentrerai d’abord sur l’influence de sTREM2 sur l’ILC dans la LMA, et ensuite sur le rôle du BDNF. L’objectif de ce projet est de comprendre comment la perte de ces facteurs affecte les fonctions antitumorales des ILC, favorise la survie des CSL et/ou module leurs interactions.
Dans l’ensemble, je m’attends à faire la lumière sur une nouvelle couche de l’immunité tumorale dans la leucémie, un contributeur clé potentiel à la progression de la maladie et à la réponse à la thérapie.
Représentation schématique du projet
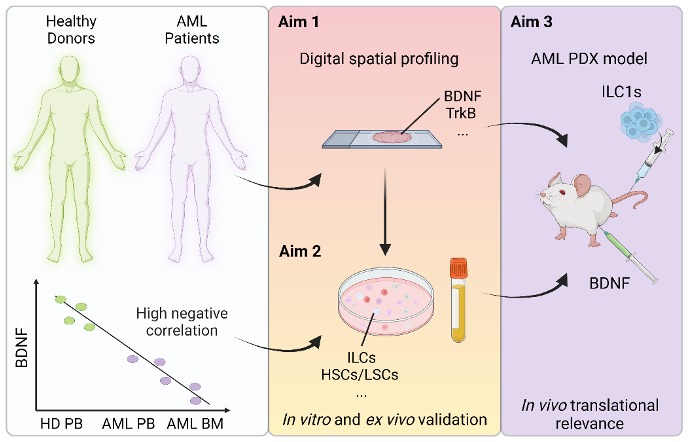
Healthy donors = Donneurs sains | AML patients = Patients atteints de LAM | High negative correlation = Corrélation négative étroite | Aim 1 = 1er objectif | Digital spatial profiling = Profilage spatial numérique | Aim 2 = 2e objectif | In vitro and ex vivo validation = Validation in vitro et ex vivo | Aim 3 = 3e objectif | AML PDX model Modèle = PDX de la LAM | In vivo translational relevance | Pertinence translationnelle in vivo
Modélisation et interrogation du micro-environnement de métastases cérébrales du cancer du poumon non à petites cellules
Cette « bourse ISREC en oncologie translationnelle » a été attribuée à Benoît Duc en novembre 2021. Benoît Duc effectue ses travaux dans le laboratoire de la Prof. Johanna Joyce, Ludwig Institute for Cancer Research, Université de Lausanne.
Au niveau mondial, le cancer du poumon, y compris le type le plus commun, à savoir le cancer du poumon non à petites cellules, constitue la principale cause de décès lié au cancer. La métastase, caractérisée par une propagation des cellules cancéreuses vers un nouvel organe qu’elles colonisent, représente le stade final de la progression du cancer du poumon. 20-40% des patients atteints d’un cancer du poumon développent une métastase cérébrale au cours de leur maladie. Il est donc impératif de développer de nouvelles thérapies pour le traitement de métastases cérébrales du cancer du poumon ; premièrement parce que plus de 50% des patients meurent dans l’année qui suit le diagnostic, et deuxièmement parce que ces métastases provoquent la mort de patients chez qui la maladie dans les poumons et d’autres sites de métastase est sous contrôle.
Cependant, le manque de modèles animaux représentant fidèlement les métastases cérébrales du cancer du poumon entrave la compréhension des mécanismes moléculaires sous-jacents. Un futur ciblage thérapeutique dépend pourtant de l’identification des vulnérabilités de ces mécanismes.
Dans ce projet, nous profiterons de nos collaborations avec des pathologistes, chirurgiens et scientifiques travaillant au Swiss Cancer Center Léman et à l’étranger pour identifier de nouvelles combinaisons thérapeutiques ciblant les cellules non cancéreuses dans les tumeurs (donc le micro-environnement tumoral), y compris les cellules immunitaires. Nous développerons un modèle murin de cancer du poumon unique en son genre, qui récapitulera toutes les phases de la métastase cérébrale de ce type de cancer. Étant donné que ces souris présenteront un système immunitaire intact (ce qui n’est pas le cas dans beaucoup de modèles disponibles actuellement), nous serons en état de déterminer comment les systèmes de défense du corps réagissent à la métastase cérébrale du cancer du poumon et d’identifier des thérapies renforçant cette réaction.
Parallèlement, nous exploiterons de nouvelles technologies permettant de caractériser les interactions cellulaires qui déterminent d’une part comment les cellules non cancéreuses réagissent aux cellules cancéreuses, et d’autre part où ont lieu ces interactions au sein de la tumeur. En effectuant ces analyses sur des échantillons issus de patients et dans notre modèle animal, nous espérons identifier dans les cellules non cancéreuses des métastases cérébrales du cancer du poumon des vulnérabilités jusqu’alors inconnues, que nous pourrons ensuite cibler dans notre nouveau modèle murin. Nous avons espoir que ces recherches conduiront finalement à une gestion personnalisée des métastases cérébrales du cancer du poumon non à petites cellules, caractérisée par des traitements conçus rationnellement et ciblant des sous-types moléculaires distincts.

