Die Rolle natürlicher Killerzellen im kutanen T-Zell-Lymphom: pathophysiologische Mechanismen und klinische Bedeutung
Dieses “MD-PhD Stipendium” wurde im Mai 2023 für 3 Jahre an Christoph Iselin vergeben, welcher seine Forschung im Labor von Prof. Emmanuella Guenova an der Universität Lausanne durchführt.
Kutane T-Zell-Lymphome (CTCL) stellen eine Gruppe von seltenen, potentiell tödlichen Nicht-Hodgkin-Lymphomen dar, welche aus bösartigen CD4+-T-Zellen entstehen. Als entscheidender Faktor für das Fortschreiten der Krankheit wird das Immunsystem des Patienten erachtet. Immunmodulatorische Therapien verbessern das Behandlungsergebnis zuverlässig. Ein besseres Verständnis der Auswirkungen des CTCLs auf das Immunsystem und dessen Zellen ist somit für die Verbesserung der therapeutischen Optionen essentiell.
Die immunmodulatorischen Auswirkungen des CTCLs führen zur Erschöpfung der Immunzellen. Dies erklärt, warum bei diesen Erkrankungen die Wirkung von Therapien, die von T-Lymphozyten und dendritischen Zellen abhängen, im Vergleich zu den Ergebnissen bei anderen Krebsarten bisher enttäuschend ausfallen. Allerdings gibt es nun Hinweise, dass natürliche Killerzellen (NK) für das Ansprechen auf eine immunmodulatorische Behandlung bei CTCL mitverantwortlich sind.
Angesichts des immunmodulatorischen Charakters des CTCLs, seiner stark immunsuppressiven Tumormikroumgebung und der reduzierten Antitumoraktivität der NK-Zellen bei CTCL-Patienten, stelle ich folgende Hypothese auf: Die durch die Tumormikroumgebung induzierte Unterdrückung der NK-Zellfunktion ist ein entscheidender Faktor für die Progression des CTCLs. Die Rückgewinnung der NK-Zellaktivität kann eine wirksame Behandlungsstrategie für CTCL und Krebserkrankungen im Allgemeinen darstellen.
Das übergeordnete Ziel des Projektes ist die Rückgewinnung der durch das CTCL beeinträchtigten NK-Zellaktivität, indem die Faktoren, welche die NK-Zellfunktion negativ regulieren, gezielt anvisiert werden. In einem ersten Schritt werden mittels rechnergestützter Einzelzellsequenzierung die NK-Zellen in der Gewebemikroumgebung des CTCLs phänotypisiert. Auf der Suche nach Faktoren und Signalwegen, die die NK-Zellen im CTCL spezifisch verändern, werde ich diesen umfassenden Datensatz mit NK-Zell-Datensätzen aus gesundem Hautgewebe, entzündlichen Hauterkrankungen und soliden Hauttumoren vergleichen.
Alle potentiell interessanten Moleküle werden danach mittels Reverse-Transkriptase-PCR, Fluoreszenz-aktivierter Zellsortierung (FACS) und Protein-Immunblotting in NK-Zellen von CTCL-Patienten und, als Kontrolle, von Individuen mit oben genannten anderen Leiden validiert. Anzahl und Aktivitätszustand der NK-Zellen werden mit existierenden patientenspezifischen klinischen Daten verglichen, um den Einfluss des Krankheitsstadiums und der Progression zu beurteilen. Danach werde ich die Reversibilität der suppressiven Auswirkung vielversprechender Moleküle auf die Aktivität der NK-Zellen in vitro untersuchen und einen Kombinationstherapieplan zur Behandlung von CTCL in einem syngenen T-Zell-Lymphommodell entwickeln. So kann in vivo überprüft werden, ob die in den ersten zwei Schritten entdeckten Zielmoleküle zur Rettung des Antitumorpotenzials von NK-Zellen und zur Verbesserung des Verlaufs bei CTCL eingesetzt werden können.
Im Erfolgsfall wird dieses Projekt zum besseren Verständnis der Rolle von NK-Zellen bei Pathologie und Behandlung von CTCL, wie auch von entzündlichen Hauterkrankungen und soliden Hauttumoren beitragen. Die Faktoren und Signalwege, die zunächst durch rechnergestützte Analyse identifiziert wurden, und die danach in vitro als reversibel eingestuft und in vivo als wirksam befunden wurden, können als Grundlage für weiterführende Studien zur Prüfung ihrer klinischen Bedeutung dienen.
TREM2 hemmt die Funktion der angeborenen lymphoiden Zellen in AML
Dieses “PhD Stipendium” wurde im März 2023 für 3 Jahre an Benedetta Fiordi vergeben. Benedetta Fiordi arbeitet im Forschungslabor von Prof. Camilla Jandus an der Universität Genf.
Das Immunsystem und das periphere Nervensystem durchziehen den gesamten Körper und stellen gemeinsam sicher, dass lebensnotwendige Organe die Gewebehomöostase und den Gesundheitszustand des Individuums aufrechterhalten. Über die Gründe, warum dieses Zusammenspiel bei einer Krebserkrankung, insbesondere bei Leukämie, gestört wird oder verloren geht, ist wenig bekannt. Weitere Abklärungen sind notwendig, um Faktoren zu identifizieren, die anvisiert werden können, um den korrekten Austausch wieder herzustellen. Leukämien sind eine Gruppe von Blutkrebsen, die im Knochenmark (KM), einem stark innervierten Gewebe, entstehen.
In diesem Projekt befasse ich mich mit der akuten myeloischen Leukämie (AML), einer Krankheit, die dringend besser charakterisiert werden muss. Als Folge von Rückfällen und Resistenzen gegenüber Medikamenten beträgt die Überlebensrate insgesamt weniger als 20%. Der Hauptgrund für das Scheitern der Behandlung bei AML sind leukämische Stammzellen (LSZ), welche Resistenzen gegen die Chemotherapie entwickelt haben. Diese Zellen überleben und bringen weitere leukämische Klone hervor, welche sich wiederum vermehren und im Patienten einpflanzen. LSZ sind im KM angesiedelt und werden von Zellen und löslichen Faktoren, inklusive neuronalen Faktoren, gestützt, die die Mikroumgebung des KM, auch KM-Nische genannt, bilden. Früher publizierte Ergebnisse aus meinem Gastlabor zeigen, dass angeborene lymphoide Zellen (ILC) im KM von AML-Patienten bei Krankheitsbeginn zwar vorhanden aber funktionell fehlreguliert sind und sich nach einer Chemotherapie nur teilweise erholen. Es muss jedoch noch untersucht werden, wie ILCs mit bösartigen Zellen, einschliesslich LSZ, interagieren und ob diese Interaktion durch neurotropheFaktoren moduliert wird.
Die Familie der angeborenen lymphoiden Zellen besteht aus zwei Hauptgruppen: den Helfer-ILC (hILC) und den natürlichen Killerzellen (NK). Die Gruppe der hILC kann in drei Untertypen (ILC1, ILC2 und ILCP) unterteilt werden. Die Gruppe der NK besteht aus NK1-/NK3- and NK2-Zellen. Interessanterweise besitzen ILC1 und NK zahlreiche Gemeinsamkeiten: Sie können durch ähnliche Zytokine aktiviert werden und beide sekretieren IFN-gamma and TNF-alpha. Die Hypothese meiner Doktorarbeit lautet, dass zwei Faktoren – der Wachstumsfaktor BDNF (brain-derived neurotrophicfactor) und sTREM2 – möglicherweise eine entscheidende Rolle in der Beeinträchtigung der antileukämischen Funktionen der angeborenen lymphoiden Zellen bei AML spielen. Vor allem zu sTREM2 habe ich vielversprechende Ergebnisse erhalten. Ich werde mich in meinem Projekt primär auf den Einfluss von sTREM2 auf die ILC bei AML konzentrieren. Der zweite Fokus wird auf der Rolle des BDNF liegen. Ziel ist es zu verstehen, wie der Verlust dieser Faktoren die antitumoralen Funktionen der ILC beeinflusst, das Überleben der LSZ fördert und/oder deren Interaktionen moduliert.
Insgesamt erwarte ich von meinen Untersuchungen, dass sie Aufschluss geben über eine neue Ebene der Tumorimmunität, nämlich über den neuro-immunen Kreislauf in der Leukämie, der möglicherweise eine entscheidende Rolle im Fortschreiten der Krankheit und dem Ansprechen auf die Therapie spielt.
Schematische Darstellung des Projektes
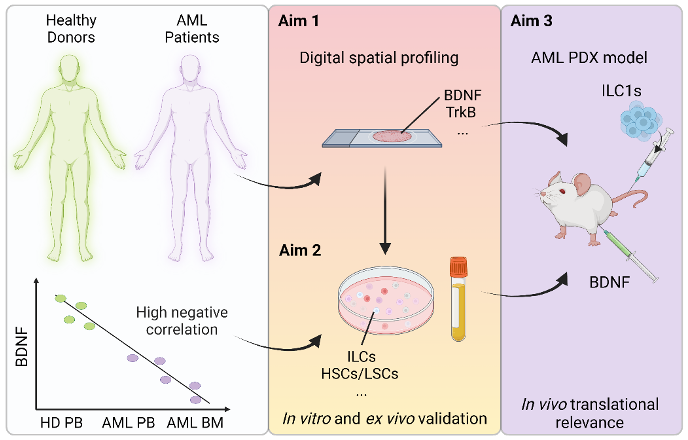
Healthy donors = Gesunde Spender | AML patients = AML-Patienten | High negative correlation = Hohe negative Korrelation | Aim 1 = 1. Ziel | Digital spatial profiling = Digitales räumliches Profiling | Aim 2 = 2. Ziel | In vitro and ex vivo validation = In vitro und ex vivo Validierung | Aim 3 = 3. Ziel | AML PDX model = AML PDX Modell | In vivo translational relevance = Translationale Relevanz in vivo
Modellierung und Untersuchung der Tumormikroumgebung von Hirnmetastasen des nicht-kleinzelligen Lungenkrebses
Dieses « ISREC Stipendium für translationale Onkologie » wurde Benoît Duc im November 2021. Benoît Duc arbeitet im Labor von Prof. Johanna Joyce, Ludwig Institute for Cancer Research, Universität Lausanne.
Weltweit ist Lungenkrebs, einschliesslich des am häufigsten auftretenden nicht-kleinzelligen Lungenkrebses, die Hauptursache für krebsbedingte Todesfälle. Die Metastasierung stellt das Endstadium der Lungenkrebsprogression dar. Dabei breiten sich Krebszellen erfolgreich auf ein neues Organ aus und besiedeln dieses. 20-40% aller Lungenkrebspatienten entwickeln im Verlauf ihrer Erkrankung Hirnmetastasen und neuartige Therapien für deren Behandlung werden dringend benötigt; erstens, weil mehr als 50% aller Patienten innerhalb eines Jahres nach der Diagnose sterben, und zweitens, weil diese Metastasen zum Tod von Patienten führen, bei denen die Erkrankung in den Lungen und in anderen Metastasenherden unter Kontrolle ist.
Allerdings fehlt es an Tiermodellen, die Hirnmetastasen des Lungenkrebses getreu nachbilden, was unser Verständnis der molekularen Mechanismen, die dieser Krankheit zugrunde liegen, limitiert. Dieses Verständnis ist jedoch unabdingbar, wenn spezifische Schwachstellen der beteiligten Mechanismen im Hinblick auf zukünftige Therapieansätze identifiziert werden sollen.
In diesem Projekt werden wir unsere Partnerschaften mit Pathologen, Chirurgen und Wissenschaftlern innerhalb des Swiss Cancer Center Léman und auch im Ausland nutzen, um neuartige therapeutische Kombinationen zu identifizieren, die nicht-krebsartige Zellen in Tumoren (d.h. die Tumormikroumgebung), darunter auch Immunzellen, ins Visier nehmen. Wir werden das erste Lungenkrebs-Mausmodell entwickeln, das alle Stufen der Lungenkrebs-Hirnmetastase nachbildet. Diese Mäuse werden ein intaktes Immunsystem besitzen, was in vielen gegenwärtig verfügbaren Modellen nicht der Fall ist. Dank dieser Eigenschaft können wir ermitteln, wie die körperliche Abwehr auf Lungenkrebsmetastasen im Gehirn reagiert. So können Therapien identifiziert werden, die diese Antwort verstärken.
Parallel dazu werden wir neue Technologien einsetzen, mit denen zelluläre Interaktionen identifiziert werden können, die entscheiden, wie nicht-krebsartige Zellen auf Krebszellen reagieren und wo im Tumor diese Interaktionen stattfinden. Wir werden diese Untersuchungen in Patientenproben und in unserem tierischen Modell durchführen, um bisher noch unbekannte Schwachstellen in nicht-krebsartigen Zellen der Lungenkrebs-Hirnmetastase zu identifizieren. Diese Schwachpunkte können wir danach in unserem neuartigen Mausmodell anvisieren. Wir hoffen, dass unsere Forschung schliesslich zur Entwicklung einer personalisierten Behandlung von aus nicht-kleinzelligem Lungenkrebs abstammenden Hirnmetastasen führt. Dabei sollen rational konzipierte Therapien unterschiedliche molekulare Subtypen ins Visier nehmen.

