Approfondir les connaissances sur le potentiel des vaccins contre le cancer

Le cancer du poumon est à ce jour la principale cause de décès associés au cancer dans le monde. Il existe un besoin urgent de développer des thérapies plus efficaces, car les tumeurs pulmonaires deviennent souvent résistantes aux thérapies conventionnelles et ciblées, telles que les immunothérapies. Cette collaboration permettra de faire progresser une thérapie anticancéreuse prometteuse, les vaccins à base de cellules dendritiques (CDs).
Les cellules dendritiques jouent un rôle fondamental dans l’orchestration des fonctions de notre système immunitaire. Elles présentent à leur surface des antigènes qui sont reconnus par d’autres acteurs de la réponse immunitaire. Leur rôle biologique est depuis longtemps exploité pour développer des vaccins à base de CD pour les patients atteints de cancer. L’objectif d’un vaccin à base de CD est de faire en sorte que le système immunitaire du patient reconnaisse et élimine les cellules cancéreuses. Plus précisément, des CD immatures sont isolées chez un patient atteint d’un cancer, puis exposées à des antigènes associés à la tumeur. Après avoir atteint leur pleine maturité, les cellules sont réintroduites chez le patient pour déclencher une réponse antitumorale. Cependant, cette approche traditionnelle présente plusieurs limites et a donné des résultats cliniques mitigés.
Ce projet TANDEM vise à faire progresser la conception de vaccins à base de CD pour la thérapie du cancer du poumon. Il exploite un nouveau type de CD, qui est modifié en laboratoire pour améliorer sa capacité à présenter des antigènes tumoraux au système immunitaire. Ce travail est sur le point d’améliorer le potentiel thérapeutique des vaccins CD et fournira, nous l’espérons, une nouvelle stratégie de traitement pour les patients atteints de cancer du poumon.
L’utilisation de nouvelles technologies de visualisation permettra de mieux comprendre la thérapie cellulaire CAR-T

Le système immunitaire joue un rôle important dans l’inhibition de la croissance tumorale. La thérapie cellulaire adoptive est une sorte de thérapie immunitaire dans laquelle les cellules du système immunitaire du patient sont extraites, reprogrammées séparément et réintroduites dans l’organisme pour combattre les tumeurs de manière très ciblée.
Plus précisément, une thérapie cellulaire adoptive utilisant des cellules T à récepteur d’antigène chimérique (CAR-T) a transformé la vie des personnes souffrant de certaines hémopathies malignes (cancers qui se développent dans le sang et forment des tissus) qui ont tendance à rechuter ou qui sont réfractaires. Les thérapies CAR-T sont en train d’être étendues au traitement des tumeurs solides. Malheureusement, la thérapie cellulaire CAR-T présente des toxicités importantes, d’autant plus que les outils précliniques permettant d’évaluer l’efficacité et la sécurité des CAR peuvent être imprécis, longs et coûteux.
L’objectif de ce projet TANDEM est d’augmenter la précision et la sécurité des cellules T modifiées en mettant en œuvre de nouvelles technologies de microscopie pour disséquer et examiner l’interaction entre la cellule CAR-T et la cellule tumorale. L’objectif est de rendre ces technologies faciles à mettre en œuvre afin qu’elles puissent être utilisées de manière routinière dans un contexte clinique. Elles permettront à leur tour de savoir si la thérapie sera efficace ou si elle sera toxique. En cas de succès, ce nouvel outil d’imagerie sera utilisé pour améliorer à la fois le pronostic et la qualité de vie globale du patient pendant le traitement CAR-T des hémopathies malignes.
Comprendre la progression de la maladie dans le cancer du poumon
L’adénocarcinome pulmonaire représente 40 % de l’ensemble des cancers du poumon, ce qui en fait l’un des cancers du poumon les plus courants. Des études antérieures ont utilisé l’histopathologie (l’étude des changements dans les tissus causés par la maladie) pour diagnostiquer et étudier les tissus pulmonaires malades au niveau microscopique. Cette approche classique a permis d’identifier les changements dans la morphologie cellulaire et les modèles de croissance qui accompagnent la progression de la maladie. L’objectif principal de la collaboration actuelle est d’utiliser de nouvelles techniques pour prédire avec plus de précision comment le cancer évoluera et s’il réagira ou non au traitement.
La progression de la maladie est due à la plasticité de l’identité cellulaire et au remodelage concomitant de l’environnement tumoral, de sorte que la reprogrammation est maintenue. Sur la base d’une analyse histopathologique, il existe quatre schémas récurrents de progression tumorale qui reflètent à la fois l’agressivité de la tumeur et le pronostic de survie du patient. Les étapes sont facilement identifiables et fournissent de nombreuses informations sur la progression de la maladie et l’hétérogénéité de la tumeur, à la fois chez un même patient et chez plusieurs patients :
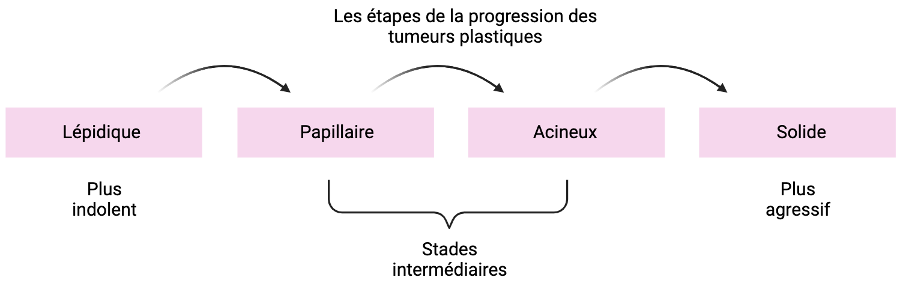
S’il est cliniquement pertinent d’identifier les stades de progression de la tumeur par l’histopathologie, les moteurs moléculaires des transitions d’un état à l’autre sont également cruciaux. À cette fin, l’équipe a caractérisé moléculairement les transitions du cancer d’une tumeur lépidique à une tumeur solide, en utilisant une combinaison de techniques pour l’analyse cellulaire unique des cellules cancéreuses et de leur interaction avec le microenvironnement tumoral.
Les objectifs de l’équipe sont les suivants : premièrement, détecter les caractéristiques moléculaires des transitions des tumeurs lépidiques vers les tumeurs solides chez tous les patients (voir figure). Deuxièmement, ils approfondiront notre compréhension de la manière dont la progression tumorale peut être prédite sur la base de l’interaction des cellules cancéreuses avec l’environnement de la cellule tumorale. L’objectif global du projet est de fournir de nouvelles informations sur le rôle de la plasticité des cellules cancéreuses dans la progression de la maladie et d’explorer si cela permet de prédire la progression de la maladie chez les patients individuels. En fin de compte, les résultats ouvriront la voie à de nouvelles pratiques de diagnostic clinique ainsi qu’à de nouvelles approches thérapeutiques du cancer du poumon.
Développement de systèmes d’IA pour aider à la stadification et au traitement des patients atteints de cancer de la vessie

Les cancers de la vessie (CV) sont généralement caractérisés comme étant superficiels ou invasifs. Comme pour tous les cancers, la tumeur doit être stadifiée afin d’établir un bon pronostic et de décider d’un traitement approprié. Actuellement, la stadification des tumeurs de la vessie dépend de la profondeur à laquelle la tumeur est imbriquée dans la paroi de la vessie. Cependant, des recherches récentes ont montré que cela ne reflétait pas nécessairement les caractéristiques les plus pertinentes sur le plan biologique des différentes formes de la maladie. L’objectif de cette collaboration est de mieux comprendre le comportement biologique du cancer de la vessie au niveau moléculaire et cellulaire, afin d’optimiser le processus de prise de décision pour un traitement efficace. Ce processus de prise de décision est sensible au temps, car le traitement doit commencer deux semaines après la prise de la biopsie.
Il est essentiel d’optimiser le processus de stadification lui-même, car la précision à ce stade aura un impact considérable sur le choix de la thérapie et la qualité de vie du patient. Le surtraitement et le sous-traitement des cancers peuvent tous deux entraîner de graves problèmes.
L’objectif global de ce projet TANDEM est d’explorer la nature biologique du CV grâce à une série de techniques moléculaires avancées à haut débit (génomique, transcriptomique, épigénétique) combinées à la surveillance des réponses fonctionnelles aux différentes thérapies. À partir de là, un atlas des types de cellules tumorales et des sensibilités sera créé, ce qui permettra aux chercheurs de générer un cadre d’IA qui devrait mieux guider les décisions de soins des patients atteints du CV. Les collaborateurs rassemblent différents types d’analyse pour faire la lumière à la fois sur la tumeur et ses tissus environnants (microenvironnement tumoral), et étudier la réponse du CV aux inhibiteurs chimiques in vitro. L’objectif est d’offrir une plateforme plus précise pour le diagnostic et la stadification des CV, permettant aux cliniciens d’associer les patients au traitement le plus efficace.
Développement d’une nouvelle thérapie pour les patients atteints d’un cancer colorectal résistant

Le cancer colorectal (CCR) est le deuxième cancer le plus fréquent et est responsable des décès liés au cancer chez les hommes et les femmes à l’échelle mondiale. Même si les options thérapeutiques se sont améliorées, notamment grâce à l’introduction prometteuse des immunothérapies, seule une fraction des patients bénéficie des traitements actuels, voire y répond. Par exemple, la thérapie par inhibiteurs de points de contrôle ne profite qu’à 5 % des patients atteints de CCR jusqu’à présent. Cette collaboration vise à développer de nouvelles options thérapeutiques indispensables, en particulier celles qui sont adaptées à chaque patient, afin de garantir une efficacité et une sécurité accrues. L’objectif est d’améliorer la qualité de vie et le pronostic des patients atteints de CCR.
Il a été démontré que les patients atteints de CCR ont une composition modifiée du microbiote intestinal, qui peut contribuer à la pathogenèse du cancer, à la résistance au traitement et à l’augmentation de la toxicité des traitements anticancéreux actuellement utilisés. Des données prometteuses montrent maintenant que des bactéries spécifiques sont capables de moduler les réponses immunitaires antitumorales et peuvent donc servir d’agents thérapeutiques potentiels ou d’adjuvants pour de nouvelles thérapies. De nouvelles études ont établi un lien entre des niveaux plus élevés d’éosinophiles intratumoraux (un type de globules blancs ayant une fonction immunitaire spécialisée) et un pronostic favorable. Les niveaux d’éosinophiles sont en corrélation avec l’amélioration de la survie des patients atteints de CCR.
L’objectif stratégique de ce projet est d’approfondir la compréhension du microbiome du patient et de son interaction avec les éosinophiles afin d’explorer leur rôle potentiel en tant que biomarqueurs moléculaires susceptibles de prédire l’évolution de la maladie et la réponse au traitement. En fin de compte, cela pourrait conduire à une médecine de précision personnalisée basée sur le microbiote pour les patients atteints de CCR.
Optimisation de l’immunothérapie du cancer chez les patients adultes et pédiatriques par transfert de lymphocytes T CD4 modifiés au niveau du TCR

Il s’agit d’un projet hautement translationnel visant à exploiter les activités tumoricides des cellules T CD4+ pour optimiser les immunothérapies contre le cancer. Le projet comprend la validation préclinique de cellules T CD4 modifiées au niveau du TCR et la mise en place d’un essai clinique de phase 1 pour les tumeurs solides récidivantes et réfractaires dans des cohortes d’adultes et d’enfants.

