Erweiterung des Wissens über das Potenzial von Krebsimpfstoffen

Lungenkrebs ist bis heute die Hauptursache für krebsbedingte Todesfälle weltweit. Es besteht ein dringender Bedarf an der Entwicklung wirksamerer Therapien, da Lungentumore häufig sowohl gegen konventionelle als auch gegen zielgerichtete Therapien, wie z. B. Immuntherapien, resistent werden. Im Rahmen dieser Zusammenarbeit soll eine vielversprechende Krebstherapie, nämlich die Impfung mit dendritischen Zellen (DZ), weiterentwickelt werden.
DZs spielen eine grundlegende Rolle bei der Steuerung der Funktionen unseres Immunsystems. Auf ihrer Oberfläche präsentieren sie Antigene, die von anderen Akteuren der Immunreaktion erkannt werden. Ihre biologische Rolle wird seit langem genutzt, um DZ-Impfstoffe für Krebspatienten zu entwickeln. Das Ziel eines DZ-Impfstoffs ist es, das eigene Immunsystem des Patienten dazu zu bringen, die Krebszellen zu erkennen und zu eliminieren. Genauer gesagt, werden unreife DZs aus einem Krebspatienten isoliert und dann mit tumorassoziierten Antigenen in Kontakt gebracht. Nachdem die Zellen ihre volle Reife erreicht haben, werden sie dem Patienten wieder zugeführt, um eine Anti-Tumor-Reaktion auszulösen. Dieser traditionelle Ansatz hat jedoch einige Einschränkungen und hat zu gemischten klinischen Ergebnissen geführt.
Dieses TANDEM-Projekt zielt darauf ab, die Entwicklung von DZ-Vakzinen für die Lungenkrebstherapie voranzutreiben. Es nutzt einen neuartigen DZ-Typ, der im Labor so verändert wird, dass er dem Immunsystem Tumorantigene besser präsentieren kann. Diese Arbeit wird das therapeutische Potenzial von DZ-Vakzinen verbessern und hoffentlich eine neue Behandlungsstrategie für Lungenkrebspatienten ermöglichen.
Der Einsatz neuer Visualisierungstechnologien wird das Verständnis der CAR-T-Zelltherapie fördern

Das Immunsystem spielt eine entscheidende Rolle bei der Hemmung des Tumorwachstums. Die adoptive Zelltherapie ist eine Art der Immuntherapie, bei der die Zellen des eigenen Immunsystems des Patienten entnommen, separat umprogrammiert und dem Körper wieder zugeführt werden, um Tumore ganz gezielt zu bekämpfen.
Genauer gesagt, eine adoptive Zelltherapie, die chimäre Antigenrezeptor-T-Zellen (CAR-T) verwendet hat sich für Menschen mit ausgewählten hämatologischen Malignomen (Krebsarten, die im blutbildenden Gewebe beginnen), die zu Rückfällen neigen oder refraktär sind, als wegweisend erwiesen. CAR-T-Therapien werden zunehmend auch zur Behandlung solider Tumore eingesetzt. Leider sind mit der CAR-T-Zelltherapie erhebliche Toxizitäten verbunden, zumal die präklinischen Instrumente zur Bewertung der CAR-Effizienz und -Sicherheit ungenau, zeitaufwändig und teuer sein können.
Das Ziel dieses TANDEM-Projekts ist es, die Präzision und Sicherheit von gentechnisch veränderten T-Zellen zu erhöhen, indem neue Mikroskopie-Technologien eingesetzt werden, um die Interaktion zwischen der CAR-T-Zelle und der Tumorzelle zu sezieren und zu untersuchen. Diese Technologien sollen einfach zu implementieren sein, damit sie routinemäßig im klinischen Umfeld eingesetzt werden können. Sie werden wiederum Aufschluss darüber geben, ob die Therapie wirksam ist oder zu Toxizität führt. Im Erfolgsfall wird dieses neue bildgebende Verfahren sowohl die Prognose als auch die Lebensqualität der Patienten während der CAR-T-Behandlung von hämatologischen Malignomen verbessern.
Das Voranschreiten der Krankheit bei Lungenkrebs verstehen

Das Adenokarzinom der Lunge macht 40 % aller Lungenkrebsfälle aus und ist damit einer der häufigsten Lungenkrebsfälle. In früheren Studien wurde die Histopathologie (die Untersuchung von krankheitsbedingten Gewebeveränderungen) eingesetzt, um krankes Lungengewebe auf mikroskopischer Ebene zu diagnostizieren und zu untersuchen. Mit diesem klassischen Ansatz wurden Veränderungen in der Zellmorphologie und den Wachstumsmustern identifiziert, die das Fortschreiten der Krankheit begleiten. Das übergeordnete Ziel der aktuellen Zusammenarbeit besteht darin, mit Hilfe neuer Techniken genauer vorherzusagen, wie der Krebs fortschreiten wird und ob er auf eine Behandlung anspricht oder nicht.
Das Fortschreiten der Krankheit wird durch die Plastizität der Zellidentität und eine gleichzeitige Umgestaltung der Tumorumgebung vorangetrieben, so dass die Reprogrammierung aufrechterhalten wird. Auf der Grundlage der histopathologischen Analyse gibt es vier wiederkehrende Muster der Tumorprogression, die sowohl die Aggressivität des Tumors als auch die Überlebensprognose der Patienten widerspiegeln. Die Meilensteine sind leicht zu identifizieren und liefern viele Informationen über das Fortschreiten der Krankheit und die Heterogenität des Tumors, sowohl innerhalb eines Patienten als auch zwischen mehreren Patienten:
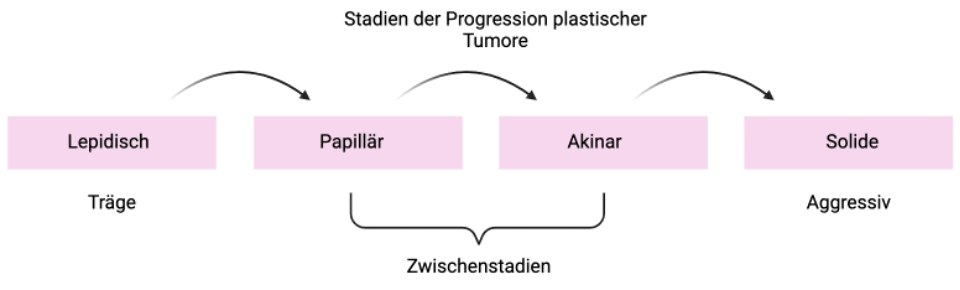
Während es klinisch relevant ist, die Stadien der Tumorprogression anhand der Histopathologie zu identifizieren, sind auch die molekularen Triebkräfte für die Übergänge von einem Stadium zum nächsten entscheidend. Zu diesem Zweck hat das Team die Übergänge des Krebses von lepidischen zu soliden Tumoren auf molekularer Ebene charakterisiert, indem es eine Kombination von Techniken zur Einzelzellanalyse von Krebszellen und deren Interaktion mit der Mikroumgebung des Tumors eingesetzt hat.
Das Team verfolgt die folgenden Ziele: Erstens sollen molekulare Merkmale der Übergänge von lepidischen zu soliden Tumoren bei verschiedenen Patienten erkannt werden (siehe Abbildung). Zweitens werden sie unser Verständnis dafür vertiefen, wie die Tumorprogression auf der Grundlage der Interaktion von Krebszellen mit der Umgebung der Tumorzellen vorhergesagt werden kann. Das übergeordnete Ziel des Projekts ist es, neue Erkenntnisse über die Rolle der Plastizität von Krebszellen beim Fortschreiten der Krankheit zu gewinnen und zu untersuchen, ob sich damit das Fortschreiten der Krankheit bei einzelnen Patienten vorhersagen lässt. Letztendlich werden die Ergebnisse den Weg für neue Praktiken in der klinischen Diagnostik sowie für neue Ansätze in der Lungenkrebstherapie ebnen.
Entwicklung von KI-Systemen zur Unterstützung bei der Stadieneinteilung und Behandlung von Blasenkrebspatienten

Blasenkrebs (BK) wird in der Regel entweder als oberflächlich oder invasiv eingestuft. Wie bei allen Krebsarten muss der Tumor eingestuft werden, um eine korrekte Prognose zu erstellen und eine geeignete Behandlungsmethode zu wählen. Derzeit hängt die Einstufung von Blasentumoren davon ab, wie tief der Tumor in die Blasenwand eingedrungen ist. Jüngste Untersuchungen haben jedoch gezeigt, dass dies möglicherweise nicht die biologisch relevantesten Merkmale der verschiedenen Formen der Krankheit widerspiegelt. Ziel dieser Zusammenarbeit ist es, das biologische Verhalten von Blasenkrebs auf molekularer und zellulärer Ebene besser zu verstehen, um den Entscheidungsprozess für eine effektive Behandlung zu optimieren. Dieser Entscheidungsprozess ist zeitkritisch, da die Behandlung spätestens zwei Wochen nach der Biopsie beginnen muss.
Das Staging-Verfahren selbst muss unbedingt optimiert werden, da die Genauigkeit an diesem Punkt einen erheblichen Einfluss auf die Wahl der Therapie und die Lebensqualität des Patienten hat. Sowohl eine Über- als auch eine Unterbehandlung von Krebserkrankungen kann ernsthafte Probleme hervorrufen.
Das Hauptziel des TANDEM-Projekts ist die Erforschung der biologischen Natur vom BK durch eine Reihe fortschrittlicher molekularer Hochdurchsatztechniken (Genomik, Transkriptomik, Epigenetik) in Kombination mit der Überwachung der funktionellen Reaktionen auf verschiedene Therapien. Auf dieser Grundlage wird ein Atlas von Tumorzelltypen und Empfindlichkeiten erstellt, der es den Forschern ermöglicht, einen KI-Rahmen zu entwickeln, der die Entscheidungen bei der Behandlung von BK-Patienten besser unterstützen soll. Die Mitarbeiter kombinieren verschiedene Analysemethoden, um sowohl den Tumor als auch das umliegende Gewebe (Tumormikroumgebung) zu beleuchten und die Reaktion des BK auf chemische Hemmstoffe in vitro zu untersuchen. Ziel ist es, eine genauere Plattform für die Diagnose und Einstufung von BK zu schaffen, damit die Ärzte die Patienten mit der wirksamsten Behandlung versorgen können.
Entwicklung einer neuen Therapie für Patienten mit resistentem Darmkrebs

Kolorektales Karzinom (KK) ist die zweithäufigste Krebserkrankung und weltweit für die krebsbedingten Todesfälle bei Männern und Frauen verantwortlich. Obwohl sich die therapeutischen Möglichkeiten verbessert haben, darunter die vielversprechende Einführung von Immuntherapien, profitiert nur ein Bruchteil der Patienten von den derzeitigen Behandlungen oder spricht sogar darauf an. So kommt die Checkpoint-Inhibitor-Therapie bisher nur 5 % der KK-Patienten zugute. Diese Kollaboration zielt darauf ab, dringend benötigte neue Therapieoptionen zu entwickeln, insbesondere solche, die an den einzelnen Patienten angepasst sind, um eine höhere Wirksamkeit und Sicherheit zu gewährleisten. Ihr Ziel ist eine Verbesserung der Lebensqualität und der Prognose für KK-Patienten.
Es hat sich gezeigt, dass Patienten, die an KK erkrankt sind, eine veränderte Zusammensetzung der Darmmikrobiota aufweisen, die zur Krebsentstehung, zur Therapieresistenz und zur erhöhten Toxizität der derzeit verwendeten Krebsbehandlungen beitragen kann. Vielversprechende Daten zeigen nun, dass bestimmte Bakterien in der Lage sind, die antitumorale Immunantwort zu modulieren und daher als potenzielle Therapeutika oder Adjuvantien für neue Therapien dienen könnten. Weitere neue Studien haben einen Zusammenhang zwischen einem höheren Gehalt an intratumoralen Eosinophilen (einer Art von weißen Blutkörperchen mit spezialisierter Immunfunktion) und einer günstigen Prognose hergestellt. Die Eosinophilenspiegel korrelieren mit einer verbesserten Überlebensrate von Darmkrebs-Patienten.
Das strategische Ziel dieses Projekts ist es, das Mikrobiom des Patienten und seine Interaktion mit den Eosinophilen besser zu verstehen, um ihre potenzielle Rolle als molekulare Biomarker zu erforschen, die den Krankheitsverlauf und das Ansprechen auf die Therapie vorhersagen können. Letztendlich könnte dies zu einer personalisierten Mikrobiom-basierten Präzisionsmedizin für KK-Patienten führen.
Transfer von CD4-T-Zellen mit modifiziertem TCR zur Optimierung der Krebsimmuntherapie bei erwachsenen und pädiatrischen Patienten

Es handelt sich um ein hochgradig translationales Projekt, das darauf abzielt, die tumoriziden Eigenschaften von CD4+-T-Zellen zu nutzen, um Krebsimmuntherapien zu optimieren. Das Projekt beinhaltet die präklinische Validierung von CD4-T-Zellen mit modifiziertem TCR und den Aufbau einer Phase 1 klinischen Studie für rezidivierende und refraktäre solide Tumoren in Erwachsenen- und Kinderkohorten.

