Benedetta Fiordi, PhD im Labor von Prof. Camilla Jandus (UNIGE) – (Akute myeloische Leukämie)
AML-Blasten stossen TREM2 ab, um die Funktion der angeborenen lymphoiden Zellen zu hemmen
Dieses “PhD Stipendium” wurde im März 2023 für 3 Jahre an Benedetta Fiordi vergeben. Benedetta Fiordi arbeitet im Forschungslabor von Prof. Camilla Jandus an der Universität Genf.
Das Immunsystem und das periphere Nervensystem durchziehen den gesamten Körper und stellen gemeinsam sicher, dass lebensnotwendige Organe die Gewebehomöostase und den Gesundheitszustand des Individuums aufrechterhalten. Über die Gründe, warum dieses Zusammenspiel bei einer Krebserkrankung, insbesondere bei Leukämie, gestört wird oder verloren geht, ist wenig bekannt. Weitere Abklärungen sind notwendig, um Faktoren zu identifizieren, die anvisiert werden können, um den korrekten Austausch wieder herzustellen. Leukämien sind eine Gruppe von Blutkrebsen, die im Knochenmark (KM), einem stark innervierten Gewebe, entstehen.
In diesem Projekt befasse ich mich mit der akuten myeloischen Leukämie (AML), einer Krankheit, die dringend besser charakterisiert werden muss. Als Folge von Rückfällen und Resistenzen gegenüber Medikamenten beträgt die Überlebensrate insgesamt weniger als 20%. Der Hauptgrund für das Scheitern der Behandlung bei AML sind leukämische Stammzellen (LSZ), welche Resistenzen gegen die Chemotherapie entwickelt haben. Diese Zellen überleben und bringen weitere leukämische Klone hervor, welche sich wiederum vermehren und im Patienten einpflanzen. LSZ sind im KM angesiedelt und werden von Zellen und löslichen Faktoren, inklusive neuronalen Faktoren, gestützt, die die Mikroumgebung des KM, auch KM-Nische genannt, bilden. Früher publizierte Ergebnisse aus meinem Gastlabor zeigen, dass angeborene lymphoide Zellen (ILC) im KM von AML-Patienten bei Krankheitsbeginn zwar vorhanden aber funktionell fehlreguliert sind und sich nach einer Chemotherapie nur teilweise erholen. Es muss jedoch noch untersucht werden, wie ILCs mit bösartigen Zellen, einschliesslich LSZ, interagieren und ob diese Interaktion durch neurotropheFaktoren moduliert wird.
Die Familie der angeborenen lymphoiden Zellen besteht aus zwei Hauptgruppen: den Helfer-ILC (hILC) und den natürlichen Killerzellen (NK). Die Gruppe der hILC kann in drei Untertypen (ILC1, ILC2 und ILCP) unterteilt werden. Die Gruppe der NK besteht aus NK1-/NK3- and NK2-Zellen. Interessanterweise besitzen ILC1 und NK zahlreiche Gemeinsamkeiten: Sie können durch ähnliche Zytokine aktiviert werden und beide sekretieren IFN-gamma and TNF-alpha. Die Hypothese meiner Doktorarbeit lautet, dass zwei Faktoren – der Wachstumsfaktor BDNF (brain-derived neurotrophicfactor) und sTREM2 – möglicherweise eine entscheidende Rolle in der Beeinträchtigung der antileukämischen Funktionen der angeborenen lymphoiden Zellen bei AML spielen. Vor allem zu sTREM2 habe ich vielversprechende Ergebnisse erhalten. Ich werde mich in meinem Projekt primär auf den Einfluss von sTREM2 auf die ILC bei AML konzentrieren. Der zweite Fokus wird auf der Rolle des BDNF liegen. Ziel ist es zu verstehen, wie der Verlust dieser Faktoren die antitumoralen Funktionen der ILC beeinflusst, das Überleben der LSZ fördert und/oder deren Interaktionen moduliert.
Insgesamt erwarte ich von meinen Untersuchungen, dass sie Aufschluss geben über eine neue Ebene der Tumorimmunität, nämlich über den neuro-immunen Kreislauf in der Leukämie, der möglicherweise eine entscheidende Rolle im Fortschreiten der Krankheit und dem Ansprechen auf die Therapie spielt.
Schematische Darstellung des Projektes
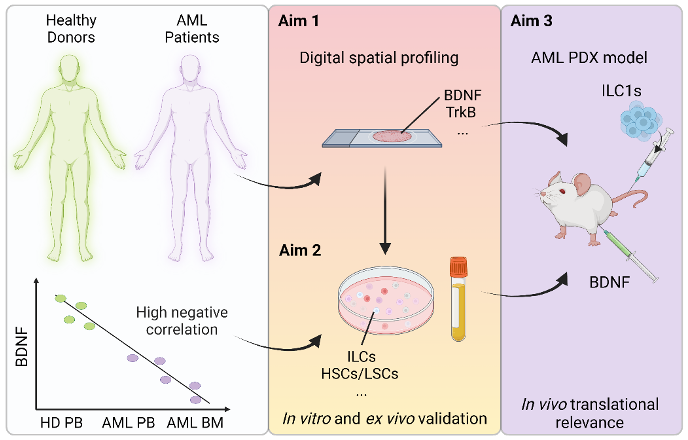
Healthy donors = Gesunde Spender | AML patients = AML-Patienten | High negative correlation = Hohe negative Korrelation | Aim 1 = 1. Ziel | Digital spatial profiling = Digitales räumliches Profiling | Aim 2 = 2. Ziel | In vitro and ex vivo validation = In vitro und ex vivo Validierung | Aim 3 = 3. Ziel | AML PDX model = AML PDX Modell | In vivo translational relevance = Translationale Relevanz in vivo

